阿尔茨海默病(Alzheimer’s Disease, AD)以进行性记忆丧失和认知障碍为特征,其核心病理标志是β-淀粉样蛋白(Aβ)沉积形成的老年斑和Tau蛋白过度磷酸化导致的神经纤维缠结。65岁以上老人是高发人群,随着全球老龄化加剧,预计到2050年AD患者将超过1亿,但其具体发病机制仍未完全阐明。
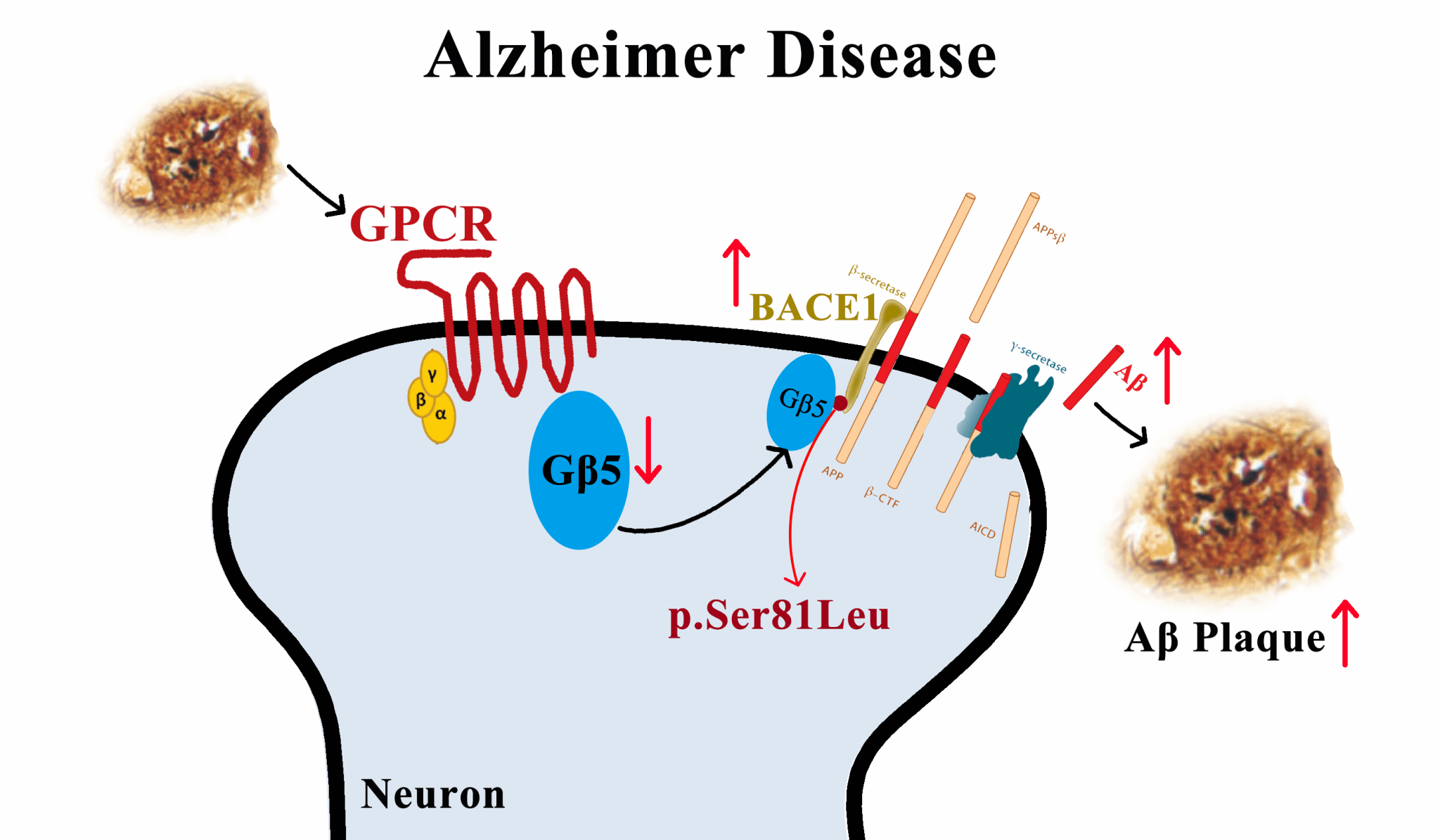
β-分泌酶(BACE1)是生成Aβ的关键限速酶。AD患者大脑中BACE1水平异常升高,但其调控机制仍不清楚。2025年7月7日,厦门大学医学院神经科学研究所张杰教授团队在国际知名期刊《PLOS Biology》上发表最新研究成果,首次揭示了G蛋白亚基β5(Gnb5)在调控BACE1活性及Aβ生成中的关键作用。该研究发现,Gnb5作为G蛋白偶联受体(GPCR)信号通路的组成部分,是BACE1的天然“刹车”,在AD中发挥着保护作用。

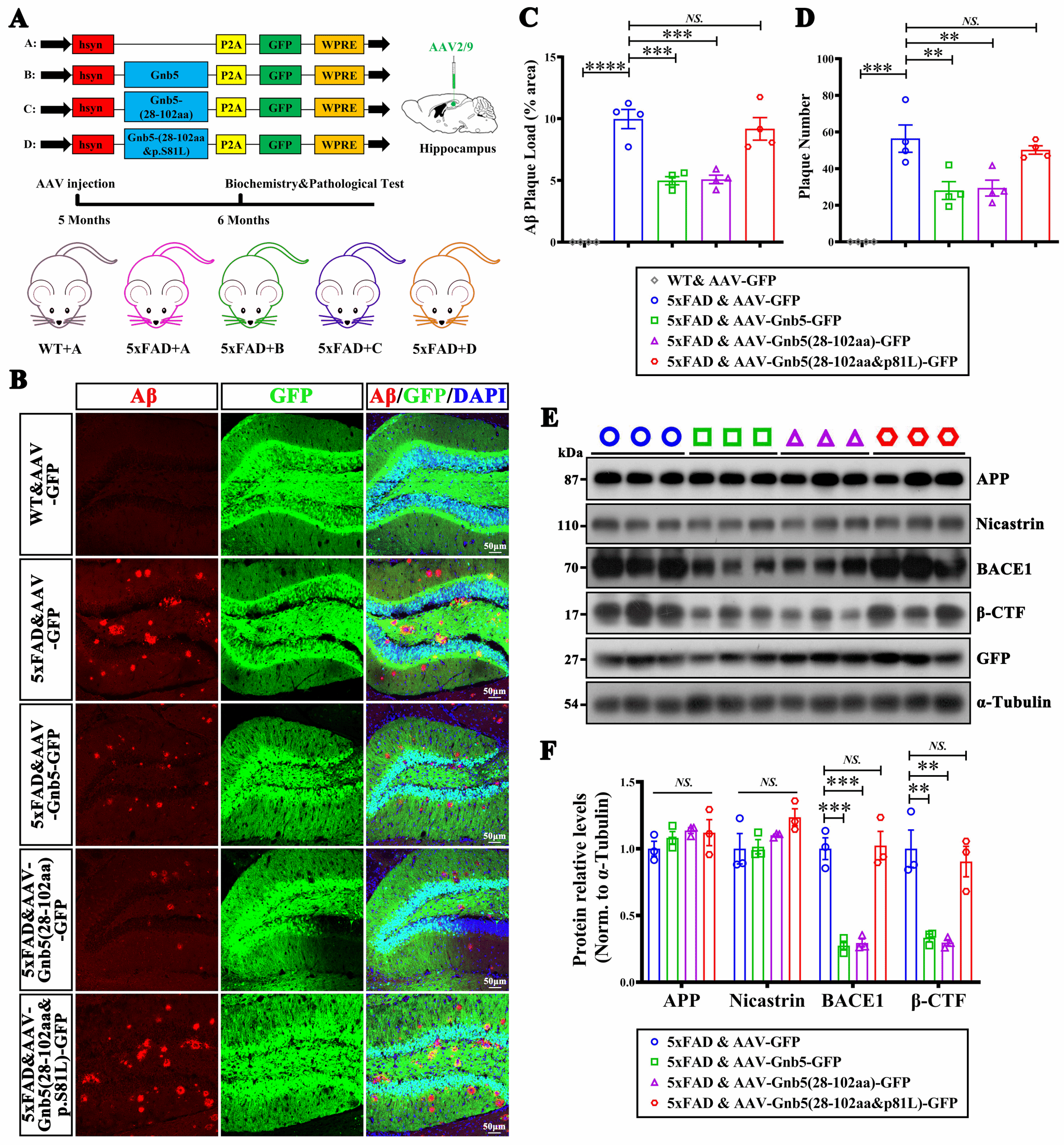
作者团队通过对AD患者样本及模型小鼠进行分析和实验验证,表明Gnb5在AD患者及小鼠模型脑内表达均显著下调。团队通过实验揭示:在兴奋性神经元中特异性敲除Gnb5会加剧小鼠认知障碍和Aβ沉积;相反,利用腺相关病毒(AAV)在海马区过表达Gnb5,则能显著改善AD小鼠的认知缺陷并减少Aβ沉积;并进一步研究发现,在AD小鼠中敲低Gnb5的表达则会加剧AD小鼠的Aβ病理。
在分子机制层面,研究证实Gnb5与BACE1存在相互作用,调节其表达并进而影响Aβ的生成。作者团队还确定了Gnb5的第一个色氨酸-天冬氨酸结构域(WD结构域)和Ser81残基对这种调节至关重要。动物实验证明:仅表达该WD结构域就足以减少AD模型小鼠的Aβ沉积;而将Ser81突变为亮氨酸(S81L),则会完全消除Gnb5的保护效应。
作者团队研究明确了Gnb5作为BACE1的关键负调节因子在阿尔茨海默病中的作用和机制,不仅为理解Aβ致病机理提供了新视角,也提示了通过调控Gnb5信号来干预AD病理过程的治疗新思路。
厦门大学医学院神经科学研究所张杰教授为本论文的通讯作者。厦门大学医学院博士生陈绍坤为本论文的第一作者。本研究工作得到国家重点研发计划项目、国家自然科学杰出青年基金、联合基金重点项目,衰老重大研究计划重点项目、国家自然科学基金面上项目、中央高校基本科研业务费、福建省杰出青年基金等的资助和支持。此外,厦门大学周杰超教授及钟力副教授为本研究提供了宝贵意见。
张杰,厦门大学医学院副院长,教授、博导、国家杰出青年科学基金、国家优秀青年科学基金等获得者。长期从事重大脑疾病比如阿尔茨海默病(AD)、抑郁症等的致病机理和药物开发研究。至今以第一作者或通讯作者发表论文40余篇,包括Nature Neuroscience, Nature Metabolism, Neuron, Sci Transl Med, Biological Psychiatry, PLOS Biology, Cell Reports, Advanced Science, PNAS等。实验室长期招聘助理教授、博士后,同时欢迎优秀学子报考厦门大学医学院张杰教授课题组研究生。联系方式:jiezhang@xmu.edu.cn
论文链接:https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.3003259
厦门大学医学院



