
近日,国际权威TOP期刊《Journal of Biological Chemistry》在线发表了吴亚林教授课题组的最新研究成果,题为“Transferrin ameliorates retinal degeneration by mediating the dimerization of all-trans-retinal”。该工作揭示了转铁蛋白(transferrin)可通过“原位”调控视觉循环紊乱缓解视网膜黄斑变性,进而有望推动常染色体隐性Stargardt病(STGD1)和干性年龄相关性黄斑变性(AMD)新治疗策略的形成。本论文的第一作者是医学院博士研究生陶磊(现为宁波大学附属第一医院住院医师),通讯作者是吴亚林教授。
年龄相关性黄斑变性(AMD)是一种影响视网膜黄斑区域,导致渐进性视力丧失的疾病,是50岁以上人群的主要致盲性眼病之一。干性AMD是AMD的主要类型,占AMD患者总数的85%以上。Stargardt病(STGD)是一种常染色体遗传性眼病,其中由ABCA4基因突变引起的类型称为STGD1,呈隐性遗传,占STGD患者总数的95%以上。STGD1通常在青少年时期发病,表现为黄斑营养不良性病变,患者在成年阶段失明。迄今为止,STGD1和干性AMD尚无有效的治疗方法。视觉循环是视觉形成的基础。它的紊乱能够引起全反式视黄醛(all-trans-retinal,atRAL)聚集于视网膜,其通过激活多种下游信号通路和形成视网膜色素上皮(RPE)脂褐素诱发视网膜退化,这被认为是STGD1和干性AMD发生的重要原因。
视网膜中atRAL异常积聚是视觉循环紊乱的后果,同时也是下游信号激活和RPE脂褐素形成的源头,进而诱发视网膜退化,导致STGD1和干性AMD患者不可逆失明。游离的atRAL是光感受器/RPE细胞死亡的刽子手,那么及时地将视觉循环紊乱产生的游离的atRAL转化为无害/低毒物质可能是更为有效地治疗视网膜黄斑变性的方法。
全反式视黄醛二聚体(atRAL二聚体)和A2E是由两分子atRAL在视网膜上缩合形成。吴亚林教授课题组前期研究发现atRAL二聚体的细胞毒性和光毒性远远低于atRAL,其光敏性很强,容易被光裂解成无毒的分子碎片(J Biol Chem 2018; Toxicology 2016)。以往的一项研究指出A2E的细胞毒性和光毒性也明显比atRAL弱(Wielgus et al. Photochem Photobiol 2010,86,781)。因此,atRAL二聚化很可能是体内最初防止游离形式的atRAL损伤视网膜的保护机制。
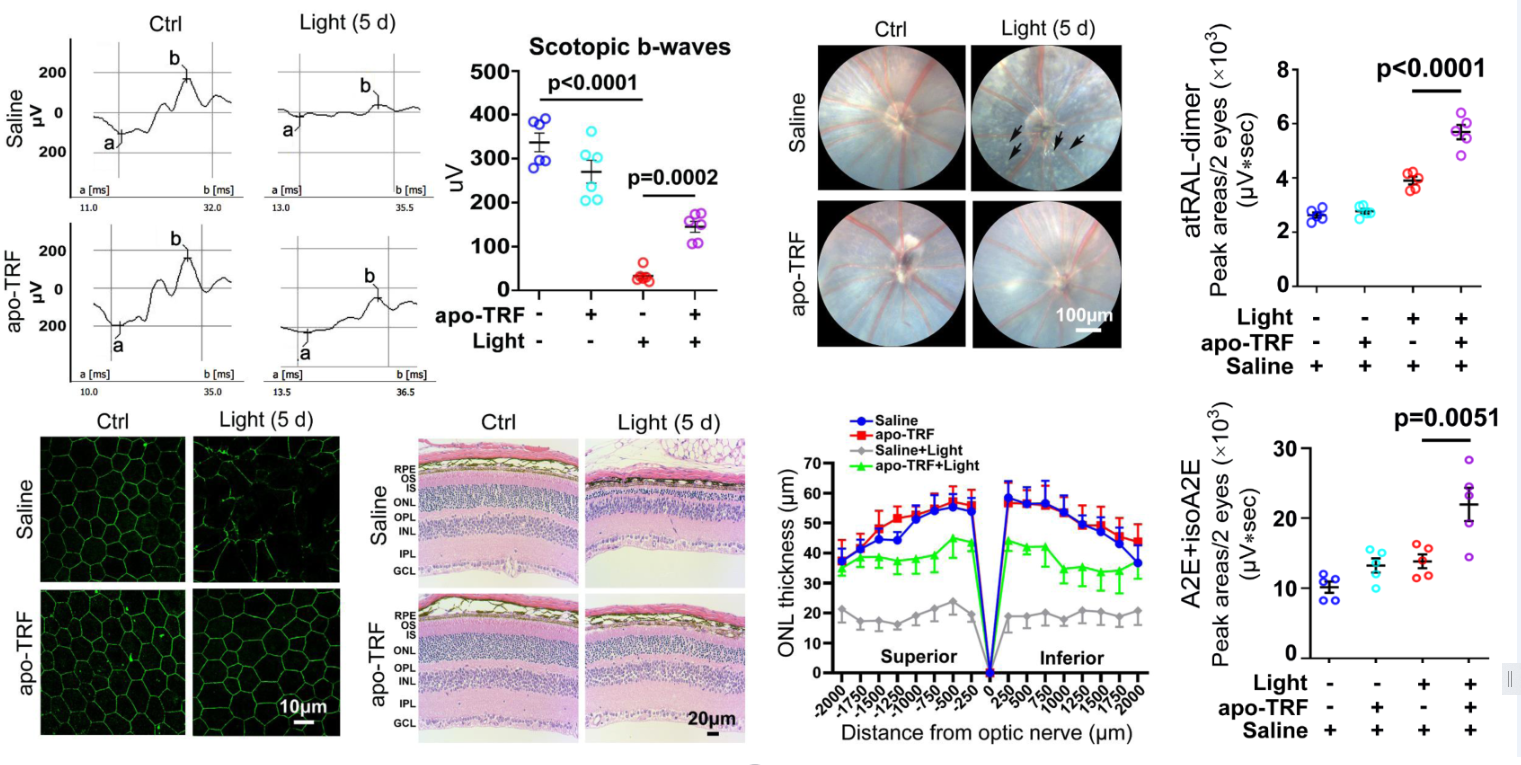
转铁蛋白Transferrin(TRF)是一种铁转运蛋白。人视网膜中TRF含量是肝脏和大脑皮层的6倍多。该研究介绍了TRF的一种新功能,即在碳酸氢根(HCO3─)的辅助下促进atRAL二聚化,其有效地保护了小鼠视网膜免受atRAL聚集诱导的损伤和功能下降,并且阻止了负载atRAL的RPE细胞死亡。“原位”干预atRAL聚集,使其转化为低毒的atRAL二聚体,再通过人们日常生活中的光线裂解atRAL二聚体为无毒的碎片,后者跨膜进入细胞间基质,在新陈代谢中消除,从而达到降低游离atRAL水平的目的。游离atRAL水平的减少,不仅可抑制下游信号的激活,同时也可阻止RPE脂褐素的形成,有望为逆转STGD1和干性AMD这类疾病提供一种全新而更加有效的策略。这是关于一种蛋白质参与视网膜中atRAL缩合反应形成类维生素A二聚体的第一篇报道。TRF可作为治疗atRAL相关视网膜疾病(如STGD1和干性AMD)的一种有前景的候选药物。该研究工作得到了国家自然科学基金、广东省自然科学基金、深圳市自然科学基金等资助。
吴亚林教授课题组长期从事视网膜黄斑变性机制与治疗的研究,以通讯或第一作者在J Biol Chem (8篇)、Free Radic Biol Med (2篇)、PNAS、Biochem J、Invest Ophthalmol Vis Sci (4篇)、J Am Chem Soc等国际知名期刊发表SCI论文41篇。主持6项国家自然科学基金项目、1项国家重点研发计划项目子课题、5项省市级自然科学基金项目和3项企业合作项目。热忱欢迎生物医学领域优秀学子报考硕士及博士研究生。



