阿尔茨海默病(AD)已成为全球威胁老年人健康的重大神经退行性疾病之一,早期诊断是目前临床防治AD的重要手段。由于AD病理机制十分复杂,其早期诊断仍面临诸多挑战。近年来,溶酶体功能障碍与蛋白质异常相分离在AD病理进展中的作用引起研究者们的广泛关注。液-液相分离(LLPS)被认为是异常蛋白聚集的重要初始事件,而自噬-溶酶体体系的酸化障碍是推动这一过程的关键环节。然而,如何在活细胞内精准、实时、原位监测溶酶体pH动态变化及相分离之间作用机制,成为制约AD早期诊断技术的难点。
近日,厦门大学医学院杨立朝教授团队联合中国科学院兰州化学物理研究所海军研究员团队在Sensors and Actuators: B. Chemical1和Analytical Chemistry2连续发文,开发了一种近红外光(NIR)/pH双重激活DNA纳米探针(UTPH),首次实现对AD病理过程中溶酶体pH动态变化的实时、原位成像分析,该技术具有高度模块化和可编程性,通过调整DNA序列中的CGC比例,可精细调控探针对溶酶体pH的敏感性范围;通过替换靶向配体,该技术可扩展应用于其它细胞器如线粒体、细胞核的动态精准监测。研究结果为AD等多种神经退行性疾病的早期诊断提供了强大而通用的分子工具,也为在亚细胞水平探索疾病机制开辟了崭新途径。

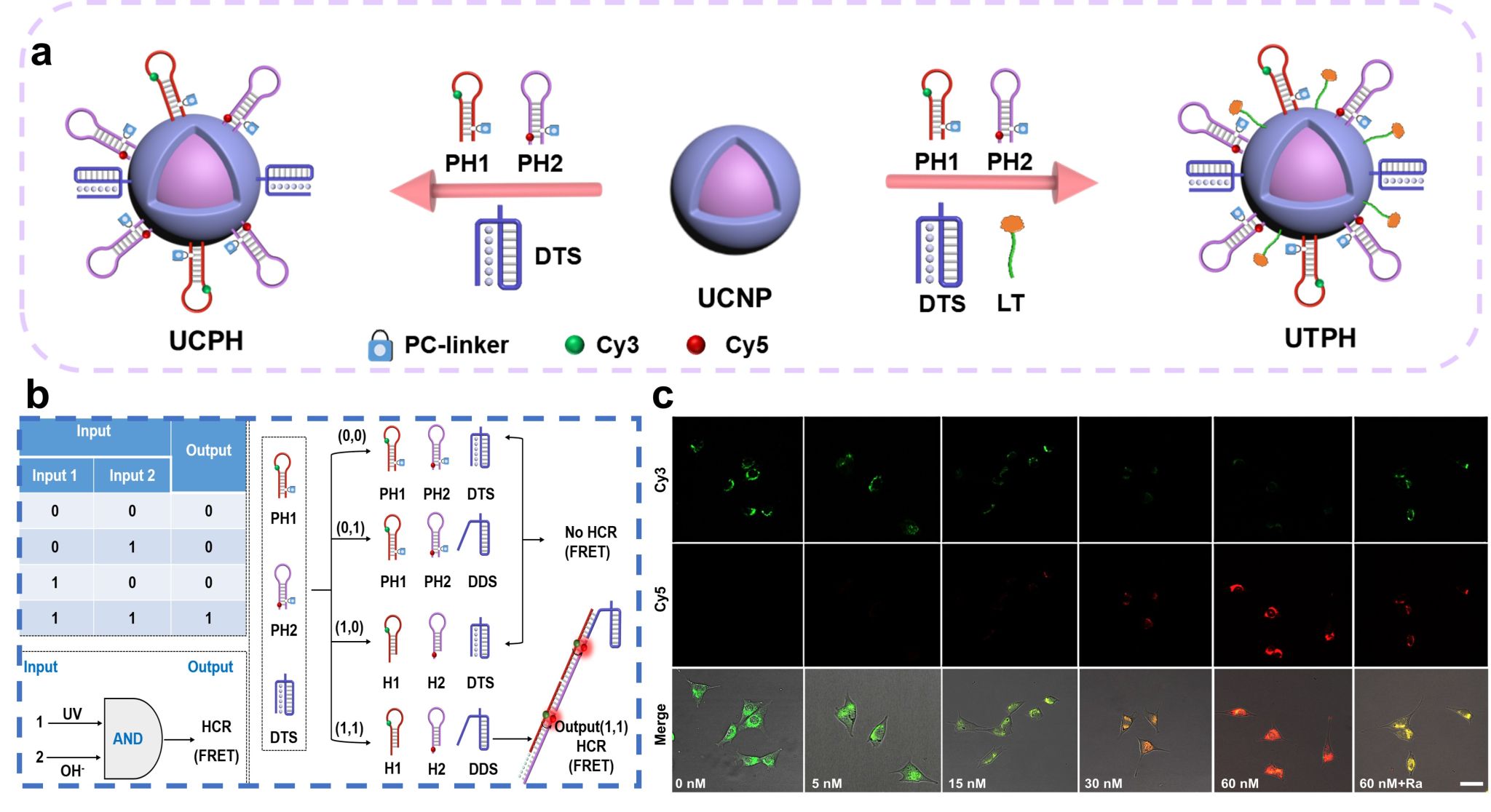
图1. UTPH纳米探针合成及模块化设计示意图
团队进一步探索溶酶体酸化障碍与Aβ蛋白相分离之间的关系。通过ATRP合成pH响应骨架,将AIE染料四苯乙烯共价连接,并自组装包载近红外ACQ染料吲哚菁绿,形成AIE/ACQ协同的纳米成像探针,实现AD自噬溶酶体酸化障碍与驱动相分离过程的可视化全流程监测。在溶酶体功能受损与Aβ聚集协同作用下,多价互作与弱相互作用共同降低体系溶解度、增强相分离驱动力,促进p62-泛素化Aβ复合体的病理性凝集。以上研究不仅实现了自噬溶酶体酸化障碍与病理性Aβ蛋白相分离的“同位、同步、同源”可视化解码,同时揭示了Aβ聚集与溶酶体功能障碍的协同作用是LLPS的重要驱动力,为相分离调控与AD早期诊断和早期干预提供了新视角与策略,有望应用于多种神经退行性疾病的早期诊断和药物开发。

海军研究员和杨立朝教授为两篇论文的共同通讯作者;中国科学院博士研究生高飞与厦门大学博士研究生林万铨为共同第一作者。以上研究得到了国家自然科学基金项目、甘肃省科技计划项目和中科院兰州化物所人才引进专项等项目的支持。
原文链接1:https://doi.org/10.1016/j.snb.2025.138389
原文链接2:https://pubmed.ncbi.nlm.nih.gov/41069155/.
文/杨立朝
审核/李炜



