骨骼干细胞(SSCs)在骨骼形成与重建中起关键作用,但其微环境(niche)中的感觉和交感神经调控机制尚不明确。
2025年10月9日和10月15日,我院许韧教授团队和附属成功医院黄建民主任医师联合美国康奈尔大学医学院Matthew B. Greenblatt教授、上海交通大学第六人民医院成伟男教授团队合作,分别在《Developmental Cell》和《Journal of Clinical Investigation》发表两项重要研究成果,系统揭示神经系统通过“阴阳平衡”双重机制调控SSCs 的命运。
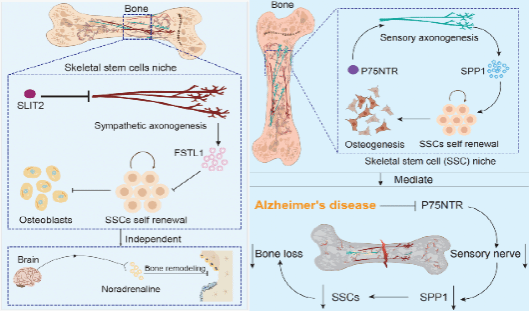
发表在《Developmental Cell》题为“The p75 neurotrophin receptor controls the skeletal stem cell niche through sensory innervation”研究论文通过构建感觉神经特异性P75NTR敲除小鼠,发现感觉神经P75NTR缺失显著降低骨内感觉神经分布密度,伴随SSC数量下降及骨量减少。进一步通过SSC移植模型、流式分析、骨组织免疫荧光成像及分子干预手段,证实了P75NTR通过调节感觉神经分泌SPP1促进SSC功能。机制研究明确了P75NTR-SPP1轴在感觉神经源促进SSC活性中的作用,为理解感觉神经如何通过可溶性因子精确调控骨干细胞命运提供了新的范式。同时,该研究还证实了阿尔茨海默病中的骨骼感觉神经退化会导致p75NTR/SPP1轴的损伤,是阿尔茨海默病导致相关的骨质减少的重要机制之一。
发表在《Journal of Clinical Investigation》题为“Axon guidance cue SLIT2 regulates the murine skeletal stem cell niche through sympathetic innervation”研究论文通过构建交感神经特异性Slit2敲除小鼠,发现交感神经SLIT2缺失显著增强骨内交感神经分布密度,伴随SSC数量下降及骨量减少。进一步通过SSC移植模型、干细胞谱系示踪、三维骨组织成像及分子干预手段,研究团队发现SLIT2并不直接作用于SSC,而是通过调节交感神经元的分泌FSTL1表达并抑制SSC功能。机制研究明确了SLIT2-FSTL1轴在神经源性抑制SSC活性中的作用,为理解交感神经如何通过可溶性因子精确调控骨干细胞命运提供了新的范式。
该系列研究首次在骨骼干细胞(SSC)微环境中提出双重神经生态位新概念:一方面,感觉神经通过分泌SPP1对SSC发挥正向调控作用,并揭示阿尔茨海默病中感觉神经退化可导致p75NTR-SPP1轴受损,是AD患者骨质减少的重要机制之一;另一方面,研究发现交感神经通过分泌FSTL1抑制SSC的成骨与自我更新,打破了以往交感神经仅依赖去甲肾上腺素抑制骨形成的传统认知,提出了SLIT2-FSTL1 轴在骨骼干细胞微环境中的负向调节作用。这一“正负调控”的发现不仅拓展了骨-神经互作的研究边界,也为解释神经系统疾病与骨代谢紊乱之间的联系提供了新的理论框架。
该系列研究由厦门大学医学院许韧教授牵头,厦门大学医学院博士后吴佐星与中山大学附属第七医院李娜助理研究员为共同第一作者,厦门大学医学院硕士研究生何雪梅、施帆、罗正琼、陈子涵、栗宇等为本研究做出了重要贡献。厦门大学生科院周大旺教授,陈兰芬教授和博士研究生黄海涛为本研究提供了特别帮助,厦门大学医学院王鑫教授、张杰教授、冷历歌教授和博士后赵依妮为本研究提供了特别指导。该研究获得国家自然科学基金重点项目(92468203)、面上项目(82372362)、福建省杰出青年基金(2022J06003)与厦门市细胞治疗研究项目(3502Z20214001)等资助。
文字:厦门大学许韧课题组
审核:李炜



