血管重塑(Vascular remodeling)是动脉粥样硬化、高血压、心肌梗死、脑卒中以及血管成形术后再狭窄等多种心血管疾病的核心病理过程,其核心特征是血管平滑肌细胞(VSMCs)发生去分化,由收缩表型向具有增殖和迁移能力的合成表型转变。然而,调控这一过程的具体分子机制仍不清晰,深入阐明其发生机制并识别可有效调控的分子靶点,对于血管重塑相关疾病的预防和延缓其进展具有重要意义。

近日,厦门大学医学院干细胞与再生医学研究所徐秀琴教授团队在心血管知名期刊《 Cardiovascular Research 》上发表研究论文“ RBM24 regulates phenotypic switching of smooth muscle cell in vascular remodeling by stabilizing JAK2 mRNA ”。 该研究系统揭示了RNA结合蛋白RBM24在VSMCs表型命运决定中的关键作用,并阐明RBM24通过稳定 JAK2 mRNA ,激活 JAK2-STAT3-KLF4信号轴,从而驱动血管重塑的核心机制。
研究团队首先在颈动脉损伤模型小鼠及PDGF-BB刺激的人源VSMCs中发现RBM24显著上调,提示其可能在血管重塑及VSMC表型转换过程中发挥重要作用。为探究其功能,团队构建了平滑肌特异性Rbm24条件敲除小鼠,结果显示Rbm24缺失可显著减轻损伤诱导的血管重塑;相反,通过AAV2/9局部过表达RBM24,则加重了损伤诱导的血管重塑。体外实验进一步表明,RBM24敲低可抑制PDGF-BB诱导的人源VSMCs去分化;RBM24过表达则促进PDGF-BB诱导的VSMCs去分化。机制研究显示,RBM24通过稳定JAK2 mRNA并激活JAK2-STAT3-KLF4信号轴,驱动VSMCs去分化,发生表型转换,从而促进血管重塑。此外,使用STAT3抑制剂Nifuroxazide可在动物模型和体外VSMCs中抑制血管重塑及表型转换,提示靶向RBM24及其下游通路有望成为防治血管重塑的新策略。
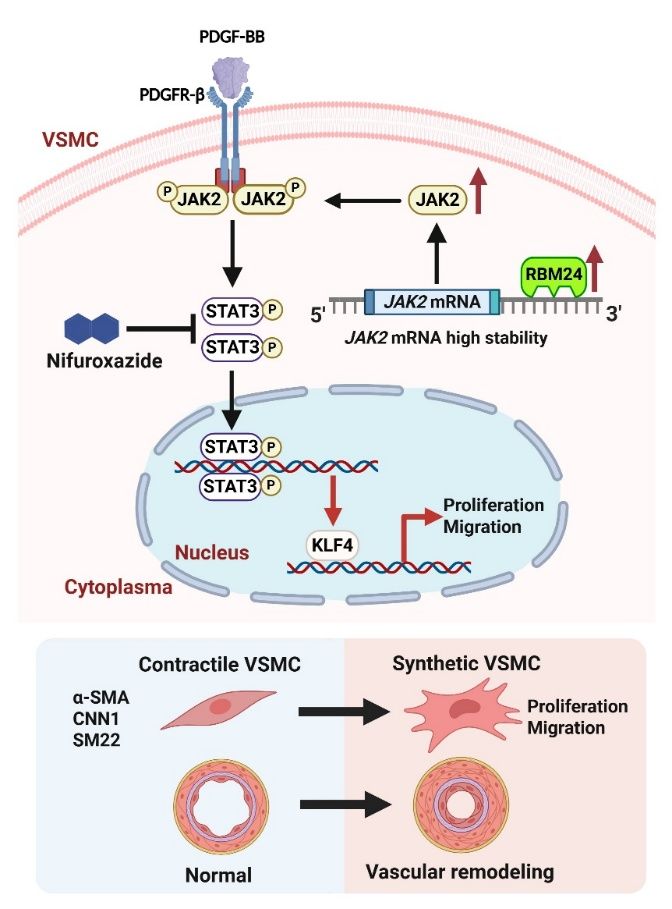
本研究揭示了 RBM24在 V SMC表型转换及血管重塑中的关键转录后调控作用,为血管重塑相关疾病的预防和治疗提供了新的潜在靶点,同时也为阐明血管疾病的转录后调控机制及开发基于RNA结合蛋白的临床转化策略提供了重要依据。
厦门大学医学院徐秀琴教授为该论文通讯作者,厦门大学医学院博士生张华伟为该论文第一作者。西南医科大学李光教授为该研究提供了大力支持。该研究获得国家自然科学基金资助。
徐秀琴教授团队长期深耕于干细胞生物学与临床转化研究,聚焦“分化—发育—疾病”的转录后调控网络。深入探究分化早期的关键调控规律,为细胞移植等临床应用提供了新的研究思路和重要理论依据。在此基础上,团队聚焦RNA 结合蛋白RBM24通过转录后调控,介导干细胞向心肌与骨骼肌分化,参与心血管及神经系统疾病的发生与进展的机制,为相关疾病提供了新的生物标志物与治疗靶点。
论文链接: https://doi.org/10.1093/cvr/cvaf219
文:徐秀琴教授团队
审核:李炜



